H3N2犬流感病毒M1蛋白的原核表达及鉴定 |
您所在的位置:网站首页 › sds-page凝胶电泳和western blot › H3N2犬流感病毒M1蛋白的原核表达及鉴定 |
H3N2犬流感病毒M1蛋白的原核表达及鉴定
|
余晓颖,田园,张国利,吴广谋,刘雨玲,李泽鸿,岳玉环* (1.吉林农业大学生命科学学院,长春130118;2.军事医学研究院军事兽医研究所,长春130122) 犬流感病毒(Canine influenza virus,CIV)属于正黏病毒科甲型流感病毒属,是一类新近发现能感染犬的流感病毒。CIV在犬间传播迅速,能引起患犬咳嗽、流涕和发热等呼吸系统疾病[1]。甲型流感病毒又根据HA分为17种亚型,NA分为9种亚型,能组成153个血清型甲型流感病毒。流感病毒基因组约为13 kb,含有8个基因节段,分别编码血凝素HA,神经氨酸酶NA,M1基质蛋白,M2离子通道蛋白,NP核蛋白,NS非结构蛋白及RNA聚合酶复合体(PB1蛋白、PB2蛋白、PA蛋白)[2]。近十年来流感病毒感染犬类病例的相关报道迅速增多,这些病毒不仅威胁到了犬的健康,同样也给公共安全带来了威胁。2004年,美国佛罗里达某赛犬场的赛犬出现体温升高、咳嗽、喷嚏为主的症状,最后因出血性肺炎死亡;2005年,美国加利福尼亚该病卷土重来,在加利福尼亚等11个州迅速蔓延,导致20个赛犬场大量赛犬发病,同时引起佛罗里达州的许多宠物犬感染;经鉴别证实该病原为亚型H3N8流感病毒,具有马流感病毒特征,并发生了变异。研究人员认为,该病最初的流行是犬与马的密切接触导致了病毒的传入和感染,并把该病称之为“犬流感”[3]。2006年,在中国南方出现了另一类犬流感,犬对H3N2亚型流感病毒的感染[4]。2007年,韩国报道了A型H3N2亚型流感病毒引起的犬呼吸道疾病。研究发现该病毒可以在犬之间进行直接传播,同时也表明H3N2 亚型犬流感病毒已经进入到韩国和我国的犬群中[5]。 M1和M2蛋白是基质蛋白,是一种非糖基化蛋白,是由甲、乙型流感病毒的7RNA节段、丙型流感病毒的6RNA节段编码[6]。非糖基化蛋白存在于囊膜蛋白的内侧,也称为内膜蛋白,是病毒粒子的主要蛋白。M1由252个氨基酸残基组成,分子量约28 kD,它是病毒的主要结构蛋白,占流感病毒蛋白总量的40%。M1蛋白在病毒感染细胞的后期才被合成,能与病毒核糖核蛋白体(vRNPs)相互作用,抑制病毒mRNA的转录,并协助vRNPs从细胞核转运到细胞浆[7]。M1蛋白与流感病毒复制有关,能与HA及NA蛋白相互作用,并参与病毒子粒的装配及释放[8]。 M1蛋白在流感病毒中高度保守,是病毒粒子中最丰富和最保守的蛋白质,每个病毒粒子的分子数量至少是HA蛋白的两倍,基于保守抗原制备的抗体可以为多种亚型流感提供广谱保护[9],为此本研究拟制备H3N2型犬流感病毒M1蛋白纯品,为进一步制备通用型抗犬流感病毒抗体提供纯品抗原。 1 材料与方法1.1 材料 1.1.1 病毒基因、质粒和菌种 H3N2犬流感病毒全基因组cDNA由军事医学研究院军事兽医研究所生物技术应用与基因工程药物实验室保存;pET-SUMO质粒、大肠杆菌One Shot®Mach1TM-T1R感受态细胞和E.coliBL21(DE3)购于美国英杰生命技术有限公司。 1.1.2 主要试剂 引物由长春库美生物公司合成;Ex TaqDNA聚合酶和T4 DNA连接酶购于宝生物工程(大连)有限公司;质粒提取试剂盒、DNA凝胶回收试剂盒、BCA蛋白浓度试剂盒、HRP标记的抗His标签的鼠的单克隆抗体和HRP标记的羊抗属IgG均购于北京康为世纪生物科技有限公司;卡纳霉素及氨苄西林购于宝泰克生物技术有限公司;甘氨酸、丙烯酰胺、诱导剂IPTG及SDS购于Sigma公司;CuSO4化学试剂为国产分析纯购于北京化工厂;SP-Sepharose Fast Flow 层析填料和Chelating Sepharose Fast Flow层析填料购于美国GE Healthcare。 1.1.3 实验动物 昆明鼠,6周龄,平均体重21 g,雄性,购于长春生物制品研究所有限责任公司。 2 方 法2.1 引物设计与合成 根据GenBank中H3N2犬流感病毒M1基因序列(JX414245.1)设计引物。上游引物P1:5'-ATGAGTCTTCTAACCGAGGTC-3';下游引物P2:5'-CCGGAATTCTTATCACTTAAATC ̄GCTGCATCTGCACT-3'(下划线部分为EcoR I酶切位点)。引物由长春库美生物公司合成。 2.2 M1基因的扩增 以H3N2型犬流感病毒全基因组cDNA为模板,PCR扩增M1基因序列。预期扩增产物长771 bp。PCR扩增产物经1.3%琼脂糖凝胶电泳、紫外凝胶成像系统下观察。切下特异性的片段,用DNA琼脂糖凝胶回收试剂盒回收目的片段。 2.3 重组表达质粒的构建 将回收的M1基因片段连接至pET-SUMO质粒上,连接产物转化至大肠杆菌One Shot®Mach1TM-T1R 感受态细胞,摇菌鉴定,用质粒小提试剂盒提取重组质粒,然后进行PCR鉴定,正确的阳性质粒命名为pET-SUMO-M1,并送长春库美生物公司测序。利用DNAssist软件分析测序结果。 2.4 目的蛋白诱导表达及可溶性分析 将测序正确的pET-SUMO-M1质粒转化至大肠杆菌BL21(DE3)中,以IPTG为诱导剂在37 ℃条件下进行诱导表达,另设立不加入IPTG作为对照,离心收集菌液,裂解液裂解,超声处理,分离上清及沉淀,用15% SDS-PAGE凝胶电泳分析目的蛋白的表达情况。 2.5 表达产物的初步纯化 菌体超声后用10%硫酸铵沉淀和45%硫酸铵沉淀进行粗纯。之后用SP-Sepharose Fast Flow阳离子交换层析柱进行初步纯化。再用Western blot 鉴定初步纯化的蛋白产物。 2.6 目的蛋白的精纯 采用(Cu2+)-Chelating Sepharose Fast Flow 层析柱对SP-Sepharose Fast Flow阳离子交换层析柱初步纯化的样品进一步的纯化,然后用SUMO蛋白酶酶切纯化产品,用SUMO蛋白酶酶切金属螯和层析纯化后的目的蛋白,酶切条件为30 ℃ 6 h。将融合蛋白中的SUMO蛋白与M1蛋白分开,再通过(Cu2+)-Chelating Sepharose Fast Flow层析柱去掉溶液中的SUMO蛋白成分。最后通过透析法以及蛋白浓缩法提高蛋白的浓度,并使目的蛋白处在1×PBS(pH7.2)缓冲液中保存。利用薄层扫描法分析纯化后蛋白的纯度以及使用BCA蛋白浓度试剂盒测得蛋白的浓度。 2.7 M1蛋白多抗的制备 因本实验中纯化出的目的蛋白始终为4条带,为验证这4条带是否均为目的蛋白,特制备鼠抗M1蛋白多抗对其进行检验。用聚丙烯酰胺凝胶电泳分离目的蛋白,将准确的相对分子质量为28 kD的M1蛋白凝胶条带取出,免疫小鼠,制备多抗。将M1蛋白纯品与氢氧化铝佐剂按9∶1混合,经皮下注射昆明鼠,50 μg/只,首次免疫前通过尾部采血分离血清,间隔两周免疫1次,共免疫3次,并在免疫后第14、21、28和42天尾部采血分离血清。根据间接ELISA法测抗体效价,以高于对照组平均值的两倍以上的最终稀释倍数为检测样品的效价。 2.8 目的蛋白的鉴定 取目的蛋白进行12% SDS-PAGE电泳分离,利用半干转移法将目的蛋白和蛋白Marker转移到PVDF膜上;然后将PVDF膜浸泡在含3% Milk的PBS缓冲液中,在4 ℃条件下封闭10 h,用PBS洗涤3次;一抗用M1蛋白(28 kD)免疫小鼠制备的抗体(1∶1000稀释),37 ℃孵育2 h,用PBST洗涤3次,二抗用HRP标记的羊抗鼠抗体(1∶3000稀释)孵育,37 ℃孵育2 h,用TBST洗涤3次,最后用DAB进行显色并分析。 3 结果与分析3.1 M1基因的扩增 以H3N2犬流感病毒全基因组cDNA为模板,进行PCR扩增,扩增产物经1.3%琼脂糖凝胶电泳分析,条带大小为771 bp,与预期结果相符(图1)。 3.2 重组表达质粒pET-SUMO-M1的构建及PCR鉴定 通过1.3%琼脂糖凝胶电泳分析结果显示,被插入的片段大小为771 bp,大小与预期相符(图2)。重组质粒pET-SUMO-M1测序结果用DNAssist软件分析显示,其插入外源序列与GenBank中H3N2犬流感病毒M1基因序列一致,M1目的基因片段以正确的方向插入到pET-SUMO质粒中,重组表达质粒构建成功。
M: DL2000 DNA Marker;1: M1基因PCR产物;2:阴性对照M: DL2000 DNA Marker;1: M1 gene PCR product;2:Negative control图1 犬流感病毒M1蛋白基因扩增结果Fig 1 Canine influenza virus M1 protein gene amplification results
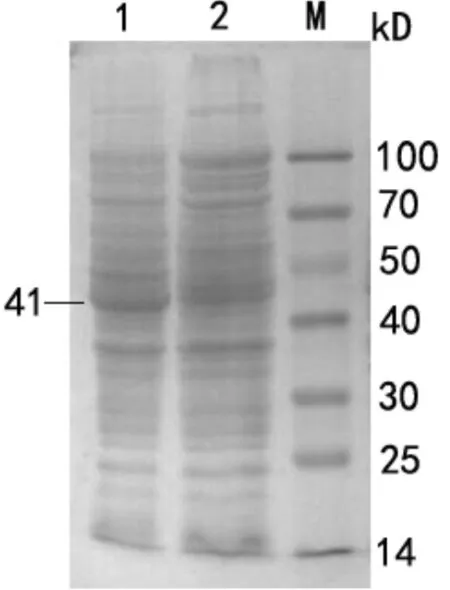
M: DL2000 DNA Marker;1:PET-SUMO-M1重组质粒PCR产物M: DL2000 DNA Marker;1:PET-SUMO-M1 recombinant plasmid PCR product图2 PET-SUMO-M1重组质粒PCR鉴定结果Fig 2 PCR identification results of PET-SUMO-M1 recombinant plasmid 3.3 目的蛋白诱导表达及可溶性分析 表达的融合蛋白SUMO-M1经15%SDS-PAGE分析,可清晰看到融合蛋白大量表达,相对分子质量为41 kD(图3)。工程菌超声处理后,上清液和沉淀经15% SDS-PAGE分析,表达的融合蛋白主要在上清液中,因此融合蛋白以可溶形式表达(图4),薄层扫描显示表达量占菌体总蛋白的25.6%。
M:蛋白质Marker;1:诱导的工程菌;2:未诱导的工程菌M:Protein Marker;1:Induced engineering bacteria;2:Uninduced engineering bacteria图3 工程菌诱导表达结果SDS-PAGE分析Fig 3 SDS-PAGE analysis of induced expression of engineering bacteria
M:蛋白质Marker;1:超声后上清液;2:超声后沉淀M:Protein Marker;1:Supernatant after ultrasonic treatment;2:Post-ultrasonic precipitation图4 工程菌超声破碎后SDS-PAGE分析Fig 4 SDS-PAGE analysis of engineering bacteria after ultrasonication 3.4 重组融合蛋白的纯化和Western blot分析 诱导后的工程菌超声处理,上清通过硫酸铵沉淀法粗纯,重组融合蛋白主要在45%硫酸铵沉淀中,经SP-Sepharose Fast Flow 阳离子交换层析柱,线性洗脱收集蛋白峰经15% SDS-PAGE分析,重组融合蛋白主要在21%B~100%B洗脱样品中,蛋白的相对分子质量为41 kD,大小与预期相符(图5),但纯化出的重组融合蛋白41 kD条带下面紧连着3条大小不同的条带,由于重组融合蛋白N端带有6×His标签,用Western blot分析鉴定显示,纯化的重组融合蛋白能够被抗His标签的鼠的单克隆抗体识别(图6),表明重组融合蛋白获得正确表达,具有良好的免疫原性,且四条条带均可发生免疫反应。 3.5 目的蛋白的纯化 取SP阳离子交换层析柱纯化出的重组融合蛋白,经(Cu2+)-Chelating Sepharose Fast Flow层析柱第二步精纯除杂蛋白,15% SDS-PAGE分析显示,重组融合蛋白在洗脱液B(40 mmol/LPB、0.3 mol/L NaCl、150 mmol/L咪唑,pH6.6)中(图7)。重组融合蛋白经SUMO蛋白酶酶切后,通过第三步(Cu2+)-Chelating Sepharose Fast Flow层析柱纯化,使目的蛋白和SUMO蛋白进行分离,经12% SDS-PAGE分析(图8),目的蛋白都在流穿液中,成功达到分离目的,获取高纯度的目的蛋白,蛋白纯度为94.6%,最终获取的目的蛋白浓度为0.541 mg/mL。
1:45%硫酸铵沉淀;M:蛋白Marker;2:流穿;3:流穿;4:21%B~74%B洗脱峰;5:75%B~100%B洗脱峰;6: 0.5mol/L NaCl 洗脱峰;7:2mol/L NaCl洗脱峰;8:0.5 mol/L NaOH洗脱峰1:45% ammonium sulfate precipitation;M:Protein Marker;2:Flow through liquid;3:Flow through liquid;4:21% B~74% B eluting peak;5:75%B~100%B eluting peak;6: 0.5mol/L NaCl eluting peak;7:2mol/L NaCl eluting peak;8:0.5 mol/L NaOH eluting peak图5 SP阳离子交换层析柱纯化结果Fig 5 SP cation exchange chromatography column purification results
M:蛋白Marker;1:SP 21%B~74%B洗脱样品;2:SP 75%B~100%B洗脱样品;3:SP 21%B~74%B洗脱样品免疫印迹;4:SP 75%B~100%B洗脱样品免疫印迹M:Protein Marker;1:SP 21%B ~ 74%B elution sample;2:SP 75%B~100%B elution sample;3:SP 21%B~74%B elution sample western blot;4:SP 75%B~100%B elution sample western blot图6 Western blot 结果Fig 6 Western blot results
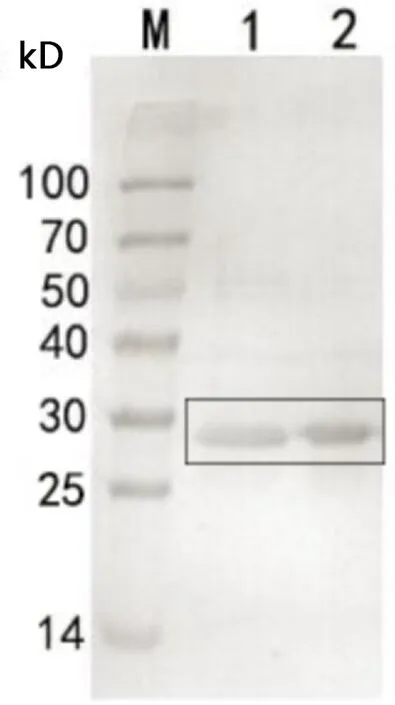
1:SP纯化后样品;2:流穿;M:蛋白Marker;3:50 mmol/L咪唑洗脱峰;4:150 mmol/L咪唑洗脱峰;5:150 mmol/L咪唑洗脱峰;6:0.1 moL/L NaOH洗脱峰1:SP purified sample;2:Flow through liquid;M:Protein Marker;3:50 mmol/L imidazole elution peak;4:150 mmol/L imidazole elution peak;5:150 mmol/L imidazole elution peak;6:0.1 moL/L NaOH elution peak图7 (Cu2+)金属螯合层析柱纯化结果Fig 7 (Cu2+) metal chelate chromatography column purification results 3.6 M1蛋白多抗的制备 经聚丙烯酰胺凝胶电泳,成功分离出M1蛋白(28 kD)纯品(图9),通过BCA方法测得制备的蛋白浓度为0.254 mg/mL。M1蛋白(28 kD)纯品免疫昆明小鼠,第0、14、21、28和42天尾部采血分离血清。根据间接ELISA法测抗体效价显示,小鼠抗体效价在免疫一周后持续增长,在免疫第42天抗体平均效价达到57左右,且达到最高(图10)。
M:蛋白Marker;1:纯化的重组融合蛋白;2-3:SUMO蛋白酶切后产物;4-5:蛋白纯品M: Protein Marker;1: Purified recombinant fusion protein;2-3: SUMO protease cut product;4-5: Pure protein图8 纯化后的目的蛋白Fig 8 Purified target protein
M:蛋白Marker;1-2:聚丙烯酰胺凝胶块中电洗脱M1蛋白纯品M:Protein Marker;1-2:Pure M1 protein prepared by electroelution in polyacrylamide gel block图9 纯化的M1蛋白SDS-PAGE分析Fig 9 SDS-PAGE analysis of purified M1 protein 3.7 纯化的目的蛋白的Western blot分析 M1目的蛋白的相对分子质量为28 kD,最终纯化的目的蛋白除了28 kD的预期条带外,M1蛋白条带下面还有3条条带。将目的蛋白进行转膜,一抗用M1蛋白(28 kD)免疫小鼠制备的抗体,二抗用HRP标记的羊抗鼠抗体,Western blot结果显示,4条条带都显色(图11),均能被用M1蛋白(28 kD)免疫小鼠制备的抗体所识别,从而证明28 kD蛋白条带下面的3条条带和M1目的蛋白性质一样,都为M1目的蛋白,也由此得出,M1目的蛋白在表达的过程中发生蛋白降解,从而出现4条条带。
图10 不同时期抗M1蛋白(28 kD)的抗体滴度Fig 10 Antibody titers against M1 protein (28 kD) at different times
M:蛋白Marker;1-2:制备出的目的蛋白纯品;3-4:制备出的目的蛋白纯品免疫印迹M:Protein Marker;1-2:Pure protein of interest;3-4:Pure target protein western blot图11 Western blot结果Fig 11 Western blot results 4 讨论与结论H3N2犬流感病毒是一类新近发现能感染犬的甲型流感病毒。犬流感病毒在犬间传播迅速,能引起患犬咳嗽、流涕和发热等呼吸系统疾病。当今社会犬作为一种伴侣动物,在现代人类生活中具有特殊的地位。由于犬和人及野生动物的亲密接触,给流感病毒的种间传播提供了更多的机会。因此,犬携带流感病毒给人类健康、犬养殖业、宠物犬造成了巨大的威胁。目前,流感病毒的变异速度非常快,常规流感疫苗几乎每年都要进行调整,以适应病毒的抗原漂移和抗原转化,给疫苗的生产制备造成诸多不便。世界卫生组织(WHO)依据当年全世界范围流感病毒变化情况来预测并推荐下一年流感疫苗生产所用组分,预测准确度将会直接影响疫苗的保护效率,若预测失败将会造成流感爆发流行的潜在威胁[9]。美国农业部已批准一种H3N8的犬流感疫苗上市使用,用于犬流感的免疫预防,可有效降低犬群的整体发病率、病程和引起的肺部损伤,但尚不能提供100%的保护,韩国也已经研制出H3N2的犬流感疫苗,但还未被批准上市,两种疫苗均为灭活疫苗。现在使用的治疗犬流感病毒的抗病毒药物有达菲、金刚乙胺和金刚烷胺,并且缺少患犬流感病犬的临床治疗报道,所以患病犬的用药剂量需参考人的用药剂量进行治疗,因此,通用型犬流感抗体药物的研究迫在眉睫[10]。M1蛋白在流感病毒中高度保守,是病毒粒子中最丰富和最保守的蛋白质,每个病毒粒子的分子数量至少是HA蛋白的两倍,基于保守抗原制备的抗体可以为多种流感亚型提供广谱保护。 在现有的表达蛋白系统中,原核表达是通过构建原核重组表达质粒,转化至大肠杆菌中,经IPTG诱导表达的蛋白表达系统,是最成熟、最稳定的,具有容易进行实验操作、时间短、成本低和获取的目的蛋白表达量高等优点。而真核表达系统,是通过构建真核重组表达质粒,转染至细胞中,通过细胞的胞内表达或者分泌表达目的蛋白,真核表达系统的加工、修饰体系更完善,目的蛋白能够形成正确的空间结构,但表达量低,时间周期长以及成本高。真核表达系统是表达生物活性蛋白及疫苗的理想选择,而原核表达系统可以提供足够的人工抗原用于诊断或不需要翻译后修饰的蛋白的结构分析[11]。鉴于实验目的是制备用于筛选抗体的具有免疫原性纯品抗原,因此本实验选择了原核表达系统来表达CIV M1蛋白,并取得了满意的结果。 此研究中,成功构建了M1基因的原核重组表达质粒pET-SUMO-M1,pET-SUMO表达质粒能够促进M1目的蛋白的可溶性表达,且质粒带有6×His标签,使表达的M1目的蛋白易于用金属螯合层析柱纯化。重组融合蛋白预期大小为41 kD,但我们纯化出的重组融合蛋白41 kD条带下面始终紧连着3条大小不同的条带,初步鉴定用HRP标记的抗His标签的鼠的单克隆抗体经Western blot分析显示,四条蛋白都显色,说明重组融合蛋白表达成功且四条带可能都是重组融合蛋白。纯化的重组融合蛋白经SUMO蛋白酶酶切后,成功将目的蛋白M1和融合蛋白分离,纯化出的M1目的蛋白28 kD条带下面同样紧连着3条大小不同的条带,为了进一步确定这3条带是否均为目的蛋白,我们采用自制抗M1多抗来进行鉴定分析,用预期大小为28 kD的M1目的蛋白免疫小鼠制备的抗体为一抗,去孵育M1目的蛋白28 kD条带及下面紧连着3条大小不同的条带,经Western blot分析,四条带都显色,再次鉴定证明,3条大小不同的条带都能和预期大小为28 kD的M1目的蛋白免疫小鼠制备的抗体发生免疫反应,也证明28 kD蛋白条带及下面的3条大小不同条带的蛋白性质一样,都为M1目的蛋白,也由此得出,M1目的蛋白在表达的过程中发生蛋白降解,从而出现4条目的条带。抗原M1目的蛋白的成功制备,为下一步制备通用型抗犬流感病毒抗体奠定了基础。 猜你喜欢 条带流感病毒质粒 农杆菌转化法中的“Ti质粒转化载体系统”的简介——一道江苏高考题的奥秘解读和拓展中学生物学(2022年7期)2022-09-07全基因组测序后质粒的组装与鉴定研究进展*成都医学院学报(2022年4期)2022-08-19文本图像条带污染去除的0稀疏模型与算法计算机应用与软件(2022年6期)2022-07-12水驱油藏高含水期耗水条带表征指标及分级方法油气地质与采收率(2022年3期)2022-05-20受灾区域卫星遥感监测的条带分解方法研究自然灾害学报(2022年2期)2022-05-10甲、乙型流感病毒感染患者外周血NL R表达对比分析临床医学工程(2022年3期)2022-04-20巧用废旧条幅辅助“蹲踞式起跑”教学中国学校体育(2021年10期)2021-04-26mcr-1阳性类噬菌体质粒与F33∶A-∶B-质粒共整合形成的融合质粒的生物学特性分析江西农业学报(2021年4期)2021-04-20开发新方法追踪植物病害的全球传播(2020.6.7 iPlants)三农资讯半月报(2020年11期)2020-06-21流感病毒为何肆虐冬春祝您健康·文摘版(2019年2期)2019-06-11
|
【本文地址】
今日新闻 |
推荐新闻 |









 中国兽药杂志2019年1期
中国兽药杂志2019年1期